Титриметрический анализ основан на точном измерении объема реагента, необходимого для завершения химической реакции. Индикаторы играют ключевую роль в этом процессе, обеспечивая визуальное определение точки эквивалентности.
Содержание
Основные причины использования индикаторов
Визуализация точки эквивалентности
- Обеспечивают четкое изменение цвета при достижении конечной точки титрования
- Позволяют определить момент завершения реакции без сложного оборудования
- Дают возможность проводить анализ в полевых условиях
Преимущества перед инструментальными методами
| Критерий | Индикаторы | Инструментальные методы |
| Стоимость | Низкая | Высокая |
| Простота использования | Высокая | Требует подготовки |
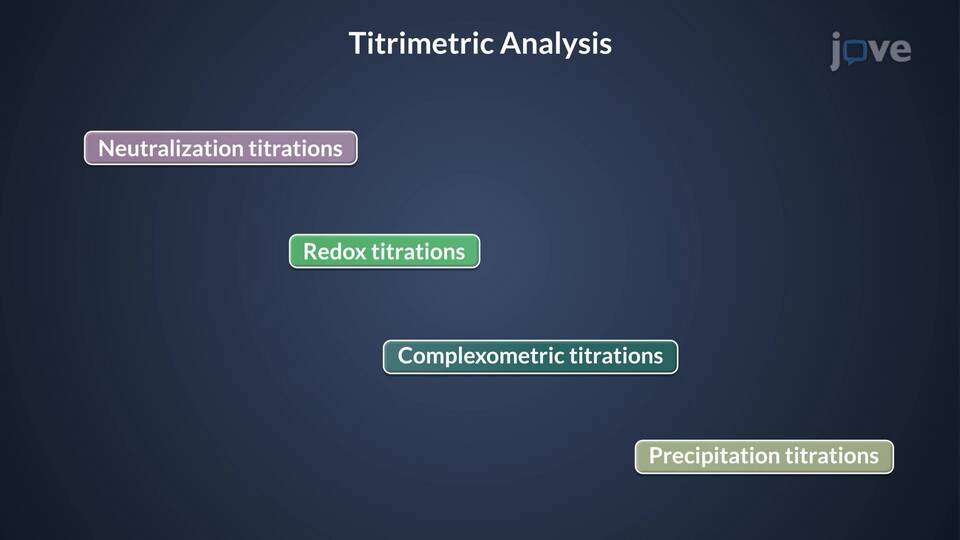
Типы индикаторов и их применение
Классификация индикаторов
- Кислотно-основные (фенолфталеин, метиловый оранжевый)
- Окислительно-восстановительные (дифениламин, ферроин)
- Комплексонометрические (эриохром черный Т)
- Адсорбционные (крахмал в йодометрии)
Критерии выбора индикатора
- Интервал перехода должен совпадать со скачком титрования
- Яркость и контрастность цветового перехода
- Химическая стабильность в рабочей среде
- Минимальное влияние на ход реакции
Научные основы применения индикаторов
Теоретические аспекты
- Теория кислотно-основного равновесия
- Константы устойчивости комплексных соединений
- Потенциалы окислительно-восстановительных систем
Точность и погрешности
| Фактор | Влияние на точность |
| Концентрация индикатора | Оптимальная 0.1% |
| pH среды | Должен соответствовать интервалу перехода |
Практические рекомендации
Оптимальные условия использования
- Правильный подбор индикатора для конкретного метода титрования
- Контроль температуры и ионной силы раствора
- Использование эталонов для тренировки визуального определения
Важное замечание
Хотя современные инструментальные методы анализа вытесняют визуальное титрование, использование индикаторов остается важным учебным инструментом и простым методом для рутинных анализов.